|
|
Процеси і апарати харчових виробництв Електронний підручник |
||
|
Лабораторні
та практичні роботи
|
6. Масообмінні процеси |
||
|
1.
Класифікація і загальна
характеристика масообмінних процесів. 2.
Рівновага і процес масообміну між
фазами. Рушійна сила масообмінних процесів, молекулярна і конвективна
дифузія. 3.
Основне рівняння масопередачі. 1.
Класифікація
і загальна характеристика масообмінних процесів. Під
масообмінними процесами розуміють процеси
переходу однієї або декількох речовин з однієї фази в іншу через межу їхнього
розділу в напрямі досягнення системою рівноважного стану. Цей перехід
речовин відбувається завдяки молекулярній і конвективній дифузіям, тому такі
процеси часто називають дифузійними. До
масообмінних процесів відносять: абсорбцію, адсорбцію, екстрагування,
перегонку, ректифікацію, кристалізацію, розчинення, сушіння та ін. Наведемо
їх стислу характеристику та сфери використання. Абсорбція
- процес вибіркового поглинання компонентів газової (парової) суміші рідким
поглиначем - абсорбентом, тобто має місце перехід речовини з газової (або
парової) фази в рідку. Використовується в цукровому (сатурація), консервному
(сульфітація), виноробному та інших виробництвах. Адсорбція
- процес вибіркового поглинання компонентів газової, парової або рідкої
суміші твердим поглиначем - адсорбентом. Широко використовується. для
очищення різноманітних харчових продуктів, наприклад, водо-спиртових
сумішей, цукрових розчинів, рослинної олії від фарбуючих речовин. Процеси
абсорбції та адсорбції часто об'єднують загальною назвою - процеси сорбції. Екстрагування
- процес вибіркового добування речовини з рідкої суміші або твердого тіла
рідиною - екстрагентом: при цьому речовина з рідкої або твердої фази
переходить у рідку. Екстрагування с основним процесом цукробурякового та
масложирового виробництв. Використовується в ресторанному господарстві,
лікеро-горілчаному, крохмало-патоковому, консервному, пивоварному та інших
виробництвах. Перегонка
- процес розділення рідких (газових, парових) сумішей шляхом випаровування
(конденсації) частини вихідної рідкої (газової, парової) суміші. Перегонка
реалізується за наявності парової (газової) і рідкої фаз у системі. Ректифікація
- процес розділення рідких сумішей на окремі компоненти або суміші (фракції)
шляхом взаємодії потоку пари і рідини. Під час ректифікації завжди існує дві
фази - рідка і парова. Процеси перегонки і ректифікації застосовуються в
спиртовому, лікеро-горілчаному, ефіроолійному, масложировому та інших
виробництвах. Кристалізація
- виділення твердої фази у вигляді кристалів з перенасичених розчинів.
Відіграє важливу роль у виробництві цукру, глюкози, кухонної солі та ін. Розчинення
- перехід твердої фази в рідку (розчинник). Використовується в усіх галузях
харчової промисловості та ресторанному господарстві. Сушіння
- вилучення вологи з твердих, пластичних і рідких матеріалів шляхом її
випаровування; при цьому волога переходить з матеріалу, який висушується, у
парову або газову фазу. Широко використовується в консервному,
харчоконцетратному, молочному і в інших виробництвах. За виглядом фаз
масообмін класифікується на процеси в системі: -
газ (пара) -- рідина: абсорбція,
ректифікація; -
газ (пара) -тверде тіло: сушіння, адсорбція
газів; -
рідина - тверде тіло: екстрагування з
твердих тіл, кристалізація, розчинення: -
рідина -
рідина: рідинна екстракція. За способом контакту між фазами
процеси можуть здійснюватися: -
безпосереднім контактом фаз; -
контактом через напівпроникні мембрани; -
без межі розділу фаз. За
способом взаємодії фаз розрізняють масообмінні процеси розрізняють:
прямотечійний, протитечійний та змішаний. За структурою робочого циклу
розрізняють масообмінні процеси періодичні та безперервні. Процеси можуть бути також стаціонарними і нестаціонарними.
Як правило всі періодичні процеси є нестаціонарними. 2.
Рівновага
і процес масообміну між фазами. Рушійна сила масообмінних процесів,
молекулярна і конвективна дифузія. Перехід
речовини з однієї фази в іншу здійснюється шляхом молекулярної
і конвективної дифузій, а також термодифузії та бародифузії.
Рис.1.
Види дифузій Молекулярна
дифузія - це перехід речовини з однієї фази в іншу внаслідок
хаотичного руху молекул у нерухомому рідкому (газоподібному) середовищі або
в ламінарному потоці. Здійснюючи безладний рух, молекули будь-якого
компонента рідини (газу) переходять з області з високою концентрацією в
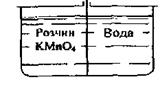
місце з меншою концентрацією. Якщо з посудини (рис. 2.), що містить у різних
камерах пофарбований розчин КМnО4
і воду, вийняти перегородку, то через короткий час відбудеться змішування
рідин так, що в обох половинках посудини розчин матиме однакові забарвлення
і концентрацію.
Рис. 2. Схема до дифузійного
перенесення речовини Переміщення розчиненої твердої речовини КМnО4 з однієї камери
посудини в іншу почалося внаслідок
різниці її концентрацій і закінчилося, коли в кожній
точці посудини концентрація стала однаковою - рівноважною. Рушійною силою процесу масообміну,
або масопередачі, є різниця між робочими і рівноважними концентраціями
розчину. Отже, процес масообміну буде відбуватися за умови С2 –Ср = Ср –С1
= ΔС, де
ΔС - різниця концентрацій; С1 і С2 - концентрації
КМпО4 у воді і розчині відповідно. Прикладом
молекулярної дифузії є й процес перенесення аерозолю, що розпилюється з
балону в нерухомому повітрі кімнати. Аерозоль з місця розпилення
розповсюджується по всій кімнаті. Аналогічно мокрий одяг, який знаходиться в
кімнаті, в кінцевому підсумку висихає, оскільки водяна пара з високою
концентрацією, оточуюча одяг, дифундує в більш сухе повітря. Молекулярна дифузія підкоряється
закону Фіка, відповідно до якого кількість речовини М, що дифундує через шар
, прямо пропорційна поверхні шару S, тривалості процесу τ, різниці-концентрацій по
обидва боки шару ΔС і обернено пропорційна товщині шару δ М = D S τ ΔC / δ де
D
- коефіцієнт пропорційності, названий коефіцієнтом молекулярної дифузії. Коефіцієнт молекулярної дифузії
залежить від властивостей дифундуючої речовини, температури, тиску і
концентрації. У чистому вигляді молекулярна
дифузія спостерігається лише в нерухомому середовищі. Конвективна дифузія
спостерігається в тих випадках, коли перенесення речовини відбувається в
рідині або газі під час їхнього перемішування або турбулентного руху. При
цьому перенесення речовини відбувається як за рахунок броунівського руху
молекул (молекулярної дифузії), так і за рахунок перенесення більших
частинок, утворених з багатьох молекул. Внаслідок цього під час конвективної
дифузії швидкість переміщення речовини у багато разів переважає швидкість
переміщення речовини під час молекулярної дифузії. Процес конвективної
дифузії можна спостерігати, якщо в посудині (рис.1.) встановити мішалку і
після вилучення перегородки включити її. Конвективна
дифузія підкорюється закону Щукарьова, згідно з яким кількість
речовини М, яка переходить від поверхні розділу фаз у середовище, що її
приймає (потік, що рухається), пропорційна поверхні поділу S, часу τ і різниці концентрацій
перехідної речовини в поверхні поділу і центрі потоку, що рухається, ΔС: M
= β
S τ ΔC де
β - коефіцієнт масовіддачі, що характеризує перенесення речовини
коивективною і молекулярною дифузіями водночас. Розглянуті нами молекулярна і
конвективна дифузії, називаються концентраційними, оскільки їхньою рушійною
силою є різниця концентрацій речовини, що переміщається. На відміну від них,
існують термічна дифузія (термодифузія) і бародифузія. Термодифузія (ефект Соре) -
молекулярна дифузія, що являє собою переміщення частинок речовини внаслідок
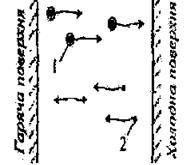
перепаду температур у рідкому (газовому) середовищі. Якщо, наприклад, між
гарячою й холодною поверхнями знаходиться рідка (газова) суміш, що містить
компоненти з різного густиною, то під впливом різниці температур важчий
компонент 1 починає рухатися до холодної поверхні, а легкий компонент 2
назустріч йому до нагрітої поверхні (рис.3.).
Рис.
3. Схема процесу термодифузії У
результаті тєрмодифузії в рідині (газі) відбудеться розподіл компонентів на
дві фракції: група компонентів, що володіють більшою густиною, збереться
біля холодної поверхні, речовини з меншою густиною - біля гарячої. Роль явища
термодифузії в харчовій технологи надто істотна, особливо під час сушіння
пористих колоїдних матеріалів. Прикладом
впливу термодифузії є зростання вологості м’якушки хлібного виробу на час
закінчення його випічки. Вологість збільшується в м'якушці на 1,5 - 2,5%
завдяки волозі, що переміщується у внутрішні шари з поверхневого шару, де
утворилася скоринка. Причиною переміщення вологи є різниця температур на
поверхні виробу t1
і всередині його t2, тобто коли t1 > t2.
Термодифузія є причиною переміщення цукристих речовин від поверхні стружки
цукрового буряка всередину іі, оскільки температура поверхні t1
більша від температури в центрі стружки t2
(явище нестаціонарної теплопровідності). Бародифузія
- молекулярна дифузія, що спричинюється неоднорідністю тиску. Помітимо, що
під час помірних перепадів температур і тиску (випадок найчастіше
трапляється в інженерній практиці) термо- і бародифузією можна зневажити
порівняно з концентраційною дифузією. Як
уже відзначалося, цілий ряд масообміяних процесів (сушіння, екстрагування,
адсорбція та ін.) визначаються перенесенням речовини всередині твердих тіл,
структура яких характеризується певною пористістю. Масоперенесення в твердій
фазі має місце і під час приготування продуктів харчування шляхом їх
теплового оброблення, тобто варення і смаження. Це перенесення здійснюється
шляхом масопровідності, при цьому всередині пор твердої фази діє, як правило,
лише механізм молекулярної дифузії. 3.
Основне рівняння масопередачі. Більшість
масообмінних процесів протікає між двома фазами, які перебувають між собою в
безпосередньому контакті. Саме тому перенесення речовини з однієї фази в
іншу проходить в декілька стадій: перенесення всередині однієї з фаз з
глибини її до поверхні поділу фаз, перехід через межу поділу фаз і
перенесення від межі поділу фаз углиб другої фази. Перенесення
маси в межах однієї фази до межі поділу фаз або від неї називають масовіддачею,
а загальний процес перенесення маси з однієї фази в іншу - масопередачею. Під час масопередачі можуть мати
місце два типових варіанта: один, характерний для систем газ - рідина і
рідина - рідина, тобто систем без твердої фази, і другий, характерний для
систем із твердою фазою (тверде тіло - рідина, тверде тіло - газ). Є
ряд теорій перенесення маси: плівкова, проникності, оновлення поверхні
фазового контакту, міжфазової турбулентності та ін. В основі їх лежать різні
спрощені моделі перенесення маси поблизу поверхні фазового контакту. Не
зупиняючись на їхній суті, відзначимо, що всі запропоновані теорії масоперенесення - це тільки більш - менш
вдалі спроби описати ті складні явища, що існують насправді, і кожна з теорій
не може вважатися повною. За
основу більшості теоретичних моделей покладено такі допущення: 1)
загальний опір перенесенню маси з однієї фази в іншу складається з опору
двох фаз і опору поверхні поділу фаз; останній у більшості випадків вважають
рівним нулю; 2)
на поверхні поділу фази знаходяться в рівновазі, причому рівновага на межі
фаз установлюється значно швидше від зміни середньої концентрації в ядрі
фаз. Процес масоперенесення в відповідності до
основного кінетичного рівняння можна описати так: М
/ Sτ
= kм ΔC або М = kм S ΔC τ де
М - маса речовини, яка переходить із однієї фази до іншої; kм -
коефіцієнт масоиередачі, який враховує опір в процесі переносу; S - площа міжфазової поверхні, через яку
здійснюється перенесення речовини;
τ - тривалість процесу;
ΔС - рушійна сила - середня різниця концентрацій речовини, яка
переходить із однієї фази до іншої. Коефіцієнт масопередачі kМ
характеризує масу речовини, яка переходить із однієї фази в іншу за одиницю
часу через одиницю поверхні контакту фаз при рушійній силі процесу, рівній
одиниці. Він залежить від властивостей речовин, що беруть участь у процесі,
та характеру взаємодії фаз. У
практичних розрахунках масообмінних процесів у ролі рушійної сили приймається
середня різниця концентрацій у їхньому початку й кінці. Середня різниця
концентрацій визначається за аналогією з методом визначення середньої
різниці температур у процесах теплообміну. Якщо ΔСmax / ΔCmin ≤
2, то ΔСсеред. = (ΔСmax - ΔCmin) / 2 При ΔСmax / ΔCmin › 2 маємо ΔСсеред. = (ΔСmax - ΔCmin) / 2,3 lg (ΔСmax / ΔCmin) ΔСmax , ΔCmin –
максимальна і мінімальна різниці концентрацій у фазах системи. Рівняння
М = kм S ΔC τ називають
основним рівнянням масопередачі. Воно
аналогічне основному рівнянню теплопередачі, яке має вигляд Q
= k S Δt τ Процеси
масообміну і теплообміну мають багато спільного. Так, явища тепловіддачі та
теплопровідності подібні відповідно процесам масовіддачі і молекулярній
дифузії. Процеси тепло - та масообміну супутні один одному. Теплообмін є
часто причиною виникнення та прискорення масообміну. Прикладами такого
тісного взаємозв'язку є випарювання, сушіння, кристалізація та інші процеси
харчових виробництв. Контрольні
запитання 1.
Які процеси
називаються масообмінними? 2.
Які процеси
відносяться до масообмінних? 3.
Як розрізняють масообмінні за
способом взаємодії фаз? 4.
Що є рушійною силою масообмінних
процесів? 5.
Що являє собою молекулярна дифузія? 6.
Що являє собою конвективна дифузія? 7.
Що являє собою бародифузія? 8.
Що являє собою термодифузія? 9.
Які варіанти можуть мати місце під
час масопередачі? 10.
Опишіть рівняння масопередачі. 11.
Що характеризує коефіцієнт
масопередачі? 12.
Що характеризує критерій Прандля? |
|||
|
Попередня тема |
Наступна тема |
||