|
|
Процеси і апарати харчових виробництв Електронний підручник |
||
|
Лабораторні
та практичні роботи
|
6.6 Кристалізація |
||
1. Загальна
характеристика процесу кристалізації. Використання її в харчовій
промисловості. Кристалізація
– це масообмінний процес утворення твердої фази у вигляді
кристалів з розчинів, розплавів, газів чи пари. Кристал
– це тверді однорідні тіла різноманітної геометричної форми, обмежені
плоскими гранями. Різна просторова орієнтація молекул у кристалі та природа
їх зв’язку зумовлюють зовнішній вигляд окремих кристалів як багатогранників
різної симетричної форми та їхні фізичні властивості. Кристали, що містять молекули
води називаються кристалогідратами.
Рис.1.
Вигляд кристала За симетрією – асиметрією
розрізняють 320 груп кристалів, які об’єднуються у сім кристалічних систем
(сингоній): триклинну, моноклинну, орторомбічну, тригональну, тетрагональну,
гексагональну, кубічну. Одержання великої кількості
кристалів у промислових умовах (наприклад, цукру) називають масовою кристалізацією. Вона проводиться
при зниженні розчинності речовини, що виділяється за рахунок вилучення
частини розчинника (наприклад, випарюванням) або зниженням температури
розчину. Кристалізація з розчину ведеться з охолодженням розплавленої маси матеріалу, головним чином
для його затвердіння (наприклад, кристалізація тригліцеридів у виробництві
маргарину).
Рис.
2. Процес кристалізації і утворення кристалів Способами кристалізації
здійснюються такі процеси харчової технології: 1)
виділення твердих розчинених речовин з розчинів; 2)
затвердіння розплавів; 3)
розподіл сумішей речовин на фракції, збагачені яким-небудь компонентом, а
інколи на практично чисті компоненти; 4)
глибоке очищення речовин від домішок. Усі
ці процеси підпорядковані загальним закономірностям, хоча й мають ряд
технологічних особливостей і відрізняються конструктивним устроєм апаратів. Кристалізація
є дифузійним процесом. Під час його здійснення відбувається масообмін між
рідкою і твердою фазами. У результаті масообміну речовина переходить з рідкої
фази в тверду. Кристалізація застосовується в харчовій промисловості під час
виробництва цукру, кухонної солі, глюкози, згущеного молока, молочного цукру,
лимонної та молочної кислот, кондитерських виробів, маргарину, соди та інших
продуктів. У деяких виробництвах кристалізація є небажаним процесом.
Наприклад, у процесі виробництва карамелі використовують різноманітні методи.
Щоб запобігти кристалізації, додають крохмальну патоку, інвертний цукор та
інші антикристалізатори.
Рис.
3. Процес кристалізації, перехід речовини з одного стану в інший У виробничих умовах процес
кристалізації складається з таких операцій: власне кристалізації, відділення
кристалів від розчину (що називається в цьому випадку маточним),
перекристалізації (у випадку необхідності), промивання кристалів та їх
наступного сушіння. Як попередню операцію, що забезпечує необхідну
концентрацію розчину перед кристалізацією, проводять випарювання. У промисловості використовують
такі основні способи кристалізації із розчинів: -
ізогідричний, коли вміст розчинника
залишається постійним, наприклад кристалізація охолодженням; -
ізотермічний, коли кристалізація здійснюється
випарюванням розчинника, а температура кипіння розчину (суспензії) в певному
інтервалі концентрації залишається постійною; -
виморожування, тобто охолодження розчину до
температури, нижчої за точку замерзання, коли частина розчинника
кристалізується і вилучається; -
висолювання, коли кристалізація відбувається
завдяки створенню пересичення введенням у розчин речовин, які знижують
розчинність речовин, що кристалізуються; -
хімічний, коли речовина кристалізується внаслідок хімічної реакції; -
комбінований спосіб, коли кристалізація відбувається завдяки спільній дії
декількох факторів. Кристалізація – це один із
найефективніших методів очищення речовин. Зворотний кристалізації процес – розчинення, при якому молекули твердої фази
розподіляються між молекулами розчинника, здійснюючи перехід твердої речовини
в розчинений стан.
Умови при яких відбувається
кристалізація. Процес кристалізації характеризується
статикою, кінетикою і динамікою. Статика кристалізації
визначає умови рівноваги між кристалами та міжкристальним розчином, а також
зв’язок між початковими і кінцевими параметрами процесу. Кінетика визначає швидкість переходу
речовини з рідкої фази у тверду. Динаміка кристалізації
визначає характер зміни параметрів системи протягом певного часу в разі
змінення умов процесу (температури, концентрації, в’язкості тощо). Процеси кристалізації відрізняються
значною складністю. Найбільш опрацьовано питання статики процесу, менше
ступені – його кінетики; динаміка процесу кристалізації з розчинів
знаходиться в початковій стадії вивчення. В основі процесу кристалізації лежить
спроможність речовин розчинятися в різноманітних рідинах – розчинниках.
Найбільш розповсюдженим розчинником є вода. Тверді речовини залежно від того
як змінюється їх розчинність зі зміною температури, можуть мати позитивну
розчинність (розчинність із підвищенням температури збільшується) і значно
рідше – негативну розчинність (з підвищенням температури розчинність
знижується). Відомо, що кожна речовина в залежності від
виду розчинника і головним чином від температури нагрівача цієї речовини має
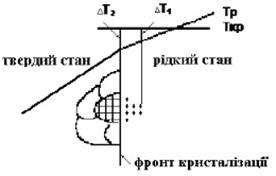
свою границю розчинності. Рушійною силою кристалізації є різниця
концентрації. У даному випадку це різниця між концентрацією перенасиченого
розчину Поняття насиченого і перенасиченого
розчинів. Розчин, що знаходиться в рівновазі з
твердою фазою за даної температури називається насиченим.
У такому розчині між твердою речовиною і розчином має місце динамічна
рівновага, яка характеризується тим, що за одиницю часу кількість частинок,
що розчиняються з кристалів і переходять у розчин, дорівнює кількості
частинок, що кристалізується в розчині та переходить у тверду фазу. Інколи концентрація розчиненої речовини
може бути більша ніж її розчинність. (Розчинність
– це концентрація речовини в насиченому розчині). Такі розчини називаються перенасиченими. Умови перенасичення розчину
досягаються: випаровуванням частинок розчинника у відкритій посудині за
температури, нижчої від точки кипіння; під час випаровування частини
розчинника у випарному апараті; під час додавання в розчин водовідбираючих
речовин; під час охолодження розчинів з позитивною розчинністю або нагрівання
розчинів з негативною розчинністю речовин. Перенасичені
розчини нестійкі, легко переходять у насичені розчини. Під час такого
переходу з перенасичених розчинів випадає тверда фаза. На цьому і оснований
один із напрямків промислового проведення кристалізації. 3.
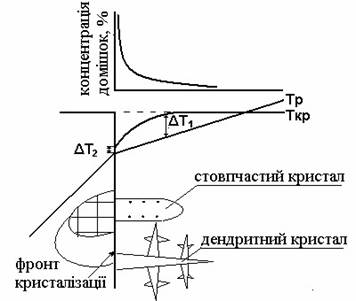
Способи кристалізації. Центри кристалізації. Процес кристалізації складається із двох
стадій: зародження частинок твердої фази (центрів кристалізації) та подальше
їх наростання. Кожна із цих стадій певною мірою визначає кінетику процесу в
цілому. Кристалізація з розчинів відбувається
навколо центрів кристалізації, що утворилися внаслідок пересичення розчинів,
або навколо подрібнених кристалів, внесених в пересичений розчин ззовні.
Центрами кристалізації можуть бути не тільки кристалики речовини, що
кристалізується, а й тверді частинки інших речовин, здатні адсорбувати на
своїй поверхні молекули розчиненої речовини. Центри кристалізації в розчинах
утворюються внаслідок виникнення зародків нової фази. В пересичених розчинах
ці зародки, що приєднуючи молекули розчиненої речовини досягають критичних
розмірів і стають здатними до подальшого росту. Такі зародки називають центрами нової фази або центрами кристалізації. Після досягнення
кристалічними зародками критичних розмірів починається стадія росту
кристалів. Природа та механізм утворення центрів
кристалізації залишається ще остаточно не вирішеним. Але відомо, що процес
може відбуватися двома шляхами: гомогенним (спонтанним) і гетерогенним.
Обидві ці механізми наявні при фазових переходах. Наприклад, у реальних
(промислових) пересичених цукрових розчинах механізм кристалоутворення є
гетерогенним. У загальній теорії кристалізації утворення
зародків кристалів розглядається як дифузійний процес, оскільки для нього
необхідна рухливість атомів у вихідній фазі та новій фазі, що утворюється. За
наявними теоретичними даними та результатами численних експериментальних
досліджень дозволяють стверджувати, що швидкість утворення зародків залежить
від температури, механічних (перемішування, струшування) та інших (наприклад,
ультразвукових) впливів, ступеня шорсткості стінок. Існують і декілька теорій росту кристалів: молекулярно-кінетична, термодинамічна,
дифузійна. Кожна з них пояснює лише окремі сторони процесу, однак єдиної
теорії росту кристалів і пояснення механізму процесу поки що немає. Згідно молекулярно-кінетичною
теорією (адсорбційною) друга стадія кристалізації – ріст кристалів – розглядається як ряд елементарних
актів приєднання до зростаючої поверхні граней молекулярних комплексів, що
утворилися в масі вихідної фази. У процесі росту кристалів відбувається
масовіддача до поверхні межового шару, дифузія речовини через цей шар до
поверхні кристалу, рух частинок вздовж поверхні кристалу і вимочення їх у
поверхневу кристалічну решітку відведення теплоти кристалізації та
вивільненої гідратаційної води від поверхні кристалу. Перехід молекул
розчиненої речовини до поверхні зростаючого кристалу прискорюється
перемішуванням, внаслідок зменшення товщини дифузійного межового шару.
Швидкість росту кристалів також збільшується з підвищенням температури, при
цьому прискорюється дифузія, полегшується підхід з розчину нових молекул
речовини, з яких складається структура кристалу. Дифузія в напрямку до центра
кристалізації виникає у зв’язку з тим, що концентрація твердої речовини
навколо кристалу менша, ніж вдалині від нього. Величина кристалів, що утворюються,
залежить від кількості центрів кристалізації в розчині. Для одержання
однорідних за розмірами кристалів вдаються до використання так званої
затравки. Затравка – це найдрібніші
частинки кристалів або навіть найдрібніші кристали тієї самої речовини, що
вносяться в перенасичений розчин. Кожна з частинок затравки є центром
кристалізації. Кристали, що утворюються, мають різні розміри, а отже і різну
масу. Наприклад, маса дрібного кристалу становить ≈ Зазвичай у виробничих умовах процес
кристалізації протікає з невеликою швидкістю, кількість центрів кристалізації
невелика, а в результаті утворюються великі кристали, які легше відстоюються,
фільтруються, утримують менше вологи під час промивання та скоріше
висушуються ніж дрібніші. Проте інколи вимоги передбачають одержання найдрібніших
кристалів. Утворення зародків нової фази. Кристалізація може відбуватися тільки на
базі стійких зародків, що утворюють центри кристалізації, розміри яких більші
за критичні. Існують два визначення, що характеризують зародок. Перше – зародок нової фази – це найменша його
частинка, що здатна до подальшого росту. Тут мова про дрібний кристалик.
Друге каже, що зародком є тільки частинка, яка перебуває в стані рівноваги з
пересиченим розчином даної концентрації, і частинки нової фази утворюються
поступово, завдяки укрупненню до зародкових асоціатів. Асоціати
– це іонні та молекулярні утворення, що складаються з різної кількості
найпростіших частинок. Перехід асоціатів до найдрібнішого кристала
здійснюється внаслідок фазового перетворення. Зародки виникають не відразу.
За умов будь-якого початкового пересичення розчину потрібен деякий час на їх
утворення. Цей час називають латентним. Говорячи про фазове перетворення,
використовують обидва терміни: зародок
і центр кристалізації. Під зародком розуміють
частинку (кристал), що перебуває в рівновазі з нестабільною рідкою фазою. В
ненасичених розчинах зародки досягають незначних розмірів і потім знову
розпадаються. В пересичених розчинах виниклі зародки досягають критичних
розмірів і стають здатними для подальшого росту. Поняття про центр
кристалізації менш визначене, але водночас і менш обмежене у своєму
застосуванні. За своєю сутністю центр кристалізації
– це здатна для подальшого росту частинка нової фази або інша тверда
частинка, що може бути центром утворення нової фази. Розмір центра
кристалізації необмежений. Методи вивчення швидкості зародкоутворення
практично зводяться до підрахунку власне центрів кристалізації, тому що
підрахувати зародки критичних розмірів досить важко через їхню мализну. Утворення зародків нової фази в гомогенних
системах найчастіше базується на термодинамічному підході, коли воно
зумовлене як формування об’єму нової фази, так і виникненням поверхні поділу
двох фаз. На утворення нової фази витрачається вільна енергія система.
Значення цієї енергії Дж. Гіббс вважав мірою стійкості метастабільної
системи. Щоб перевести систему з метастабільного
стану в стабільний (у разі утворення зародка іншої фази система переходить у
стійкий стан), треба виконати деяку роботу, тобто утворення зародків здійснюється
з поглинанням енергії, доки ці зародки не досягнуть критичного розміру.
Досягши його, зародки перебувають у стані рівноваги з вихідною фазою і
можливості їх подальшого росту та розчинення однакової. Зародки розмірами,
більшими від критичних, ростуть, і процес кристалізації відбувається з
виділенням енергії (існує поняття “теплота
кристалізації”). На процес кристалоутворення впливає велика
кількість факторів: нерозчинні домішки, в’язкість, перемішування, ультразвук,
електричне поле, магнітне поле, коливання температури тощо. Контрольні запитання 1.
Що таке кристалізація? 2.
Які зародки називають центрами нової фази або центрами кристалізації? 3.
Що таке асоціати? 4.
Зяких стадій складається процес кристалізації? 5.
Який розчин називають насиченим? 6.
Який розчин називають перенасиченим? 7.
Що таке затравка? |
|||
|
Попередня тема |
Наступна тема |
||